Vacina da Rússia contra Covid-19 ainda não iniciou testes clínicos no Brasil, diz Anvisa
Agência reguladora disse à Reuters por meio de porta-voz que ocorreram várias reuniões, mas ‘nenhum documento da vacina russa se materializou’. Candidatas britânica e chinesa já estão registrando resultados parciais de testes. Rússia planeja produzir 6 milhões de doses mensais da vacina contra a Covid-19
Os testes da vacina russa contra Covid-19, a “Sputnik-5”, ainda não começaram no Brasil, enquanto as candidatas britânica e chinesa já estão registrando resultados parciais de testes em estágio avançado, de acordo com informações da Agência Nacional de Vigilância Sanitária (Anvisa) nesta terça-feira (6).
As conclusões do estudo sobre a vacina russa contra o coronavírus
Primeiro lote da vacina russa contra Covid-19 é liberado para a população
Segundo informações de uma porta-voz da agência reguladora à Reuters, Paraná e Bahia, que têm acordos de testes, produção ou distribuição da vacina Sputnik-5, ainda não entraram com pedidos de testes clínicos (em humanos).
“Houve diversas reuniões, físicas e online, mas nenhum documento da vacina russa se materializou ainda”, disse a Anvisa à Reuters.
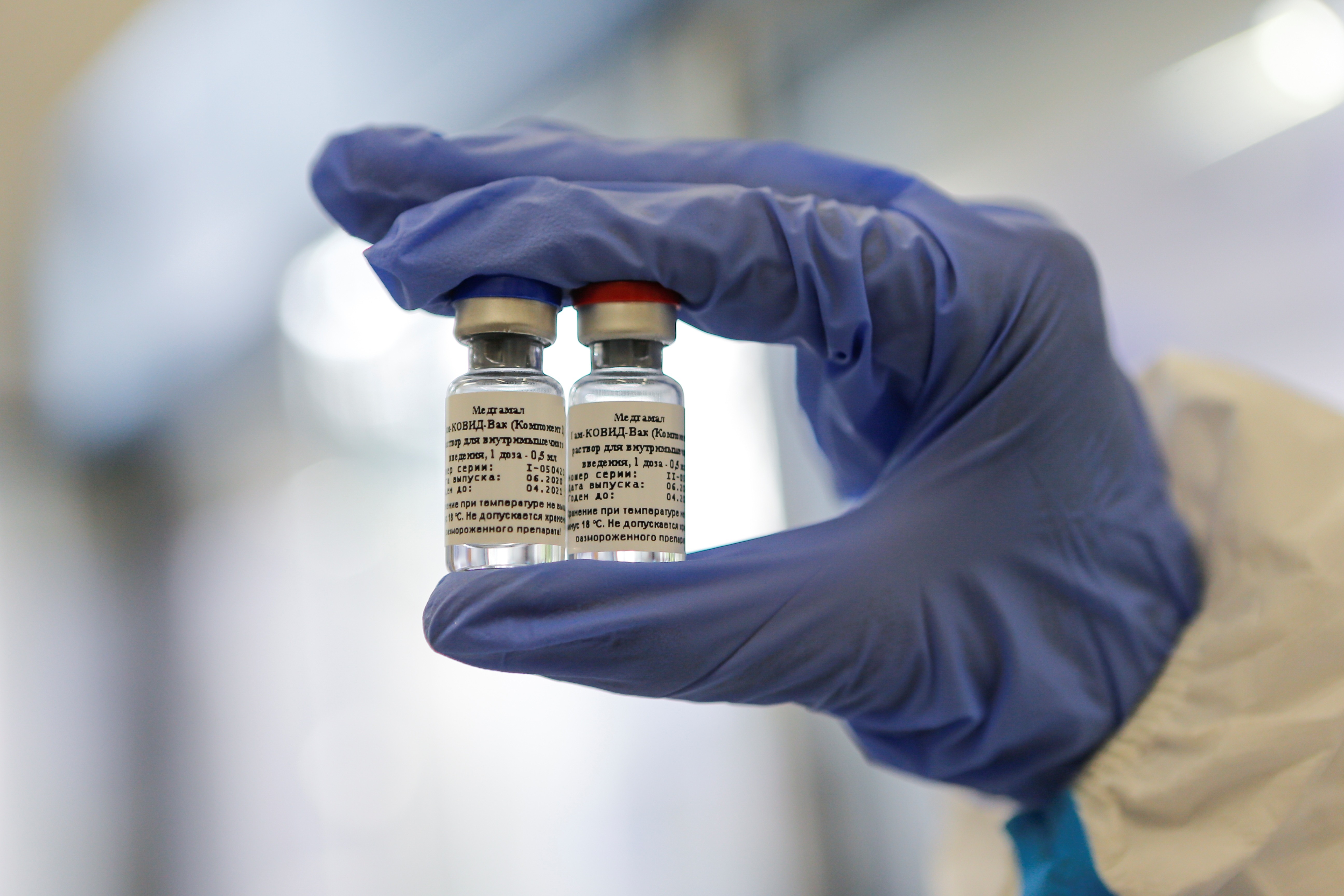
A foto, do dia 6 de agosto, mostra a vacina desenvolvida na Rússia contra a Covid-19, a primeira a ser registrada em todo o mundo contra a doença.
Handout / Russian Direct Investment Fund / AFP
O Fundo Russo de Investimento Direto (RDIF), que está comercializando a Sputnik-5, não respondeu a um pedido de comentário até a publicação desta reportagem. Enquanto isso, os testes da vacina desenvolvida pela Universidade de Oxford e pela AstraZeneca, e também da candidata da chinesa Sinovac Biotech, estão sendo realizados em vários locais do país. Dados iniciais estão sendo enviados à Anvisa.
“Este ainda não é um pedido formal de registro destas vacinas. Só cogitaremos isso quando todos os documentos tiverem sido apresentados”, disse a porta-voz à Reuters.
Em 29 de setembro, para acelerar o procedimento, a Anvisa reduziu a exigência da documentação inicial e simplificou o processo para análise dos imunizantes contra o novo coronavírus, que poderão ser enviados pelas empresas de acordo com a evolução dos trabalhos e não somente todos de uma só vez. O novo formato utilizado se chama “submissão contínua”. Veja como funciona:
Normalmente, para o registro de um medicamento ou vacina, as agências exigem todos os estudos e informações sobre a segurança, eficácia, e conteúdo de uma vez só.
Como o planeta passa por uma pandemia, a aplicação da ‘submissão contínua’ permite que os técnicos da Anvisa, ou outra agência reguladora, já comecem a analisar o que está pronto – resultados de estudos iniciais e outros dados, por exemplo.
As pesquisas são submetidas ao longo do tempo até o fim dos testes da fase 3, última etapa para garantir a eficiência de uma vacina em toda uma população. Todos os estudos deverão ser analisados pela Anvisa, com a diferença de que o processo começa antes e em etapas.
*Com informações da agência Reuters
Initial plugin text





